滚蛋吧,抑郁君! MDD疾病研究有哪些新进展?
根据世界卫生组织统计,全球抑郁症患者高达3.5亿人,每年因抑郁症自杀的人数高达百万,抑郁症不等于心情不好,它是一种病需要吃药,需要治疗。学术界对于抑郁症的认识也在不断加深,本文介绍了主流的抑郁假说,以及挖掘出领域内优秀的公司,欲知详情,请移步下文。
第一部分 MDD疾病介绍
重度抑郁症是由患者个体内遗传系统(基因)存在异常,或后天环境的巨变所引起的一种情绪性功能障碍,以持久自发性的情绪低落为主的一系列抑郁症状。表现为社交能力障碍、不合群、离群、情绪低落、躯体不适、食欲不振等特点。严重可伴有自杀。
主流的抑郁假说包括4种。
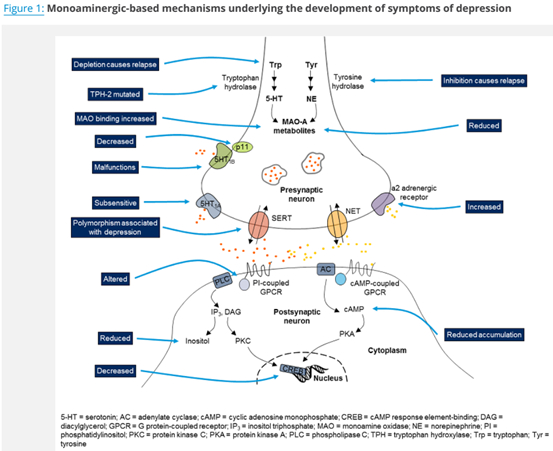
1. 单胺能假说
抑郁症的单胺假说是该疾病最具影响力的假说之一,也是第一代抗抑郁药的科学基础。该假说认为抑郁症是由大脑中突触单胺类神经递质减少引起的,即三种主要的神经递质: 羟色胺、去甲肾上腺素和多巴胺。
2. 神经营养因子/神经可塑性假说
神经营养因子可能是单胺作用治疗效果的最终促动因素。
在流行了几十年之后,抑郁症的单胺假说受到了严厉的批评,因为新出现的证据对它提出了质疑。反对单胺假说的一个主要论点是,尽管这些化合物会在几分钟到几小时内引起突触单胺的升高,但在经过几周到几个月的日常治疗后才会达到治疗效果。这导致人们猜测,抗抑郁药物的治疗作用背后可能存在下游信号分子。
事实上,根据抑郁症的神经可塑性假说,现在认为抗抑郁药物的疗效是通过多种潜在途径改善神经可塑性而获得的。结合突触后单胺受体的一个下游效应是调节参与神经可塑性的蛋白,如脑源性神经营养因子(BDNF),它在促进海马的神经发生中起作用。抗抑郁药调节神经可塑性的另一机制是通过减少前额叶皮层谷氨酸的释放。
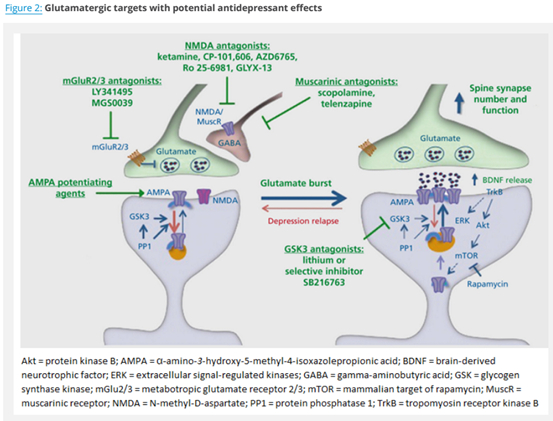
3. 谷氨酸假说
神经可塑性假说可能与谷氨酸假说有关。
越来越多的临床研究表明,抑郁症的病理生理学与主要的谷氨酸系统功能障碍有关,导致大脑中一些负责抑郁症状表达的区域发生结构性、适应性的变化。与此同时,大量的临床前数据表明,谷氨酰胺能传递的药理学调节剂导致神经营养因子如BDNF的表达,而BDNF又会产生与抗抑郁反应相关的强大的突触/细胞可塑性变化。这些丰富的发现促成了范式的转变,从抑郁的单胺假说转向关注谷氨酸的神经营养/神经可塑性假说。这可能代表了抑郁症工作假说的一个重大进展,这将推动具有新的作用机制的新药和治疗方法的发展。大脑中谷氨酸能传递的调节可以触发快速抗抑郁反应的机制如下图所示。
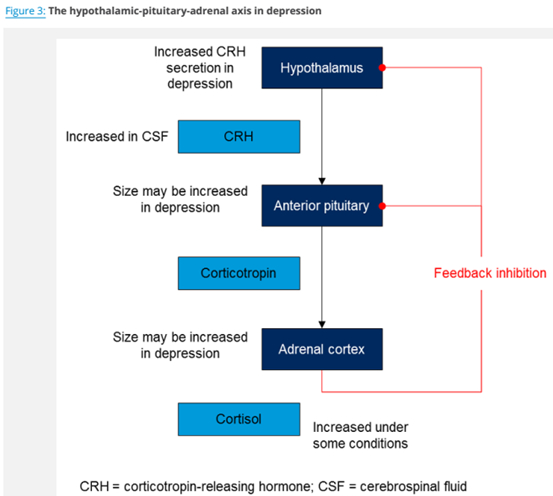
4. 下丘脑-垂体-肾上腺轴亢进假说
下丘脑-垂体-肾上腺轴(HPA轴)也参与抑郁症的病因学。另一个关于抑郁症的主要假说是压力皮质醇假说。环境压力似乎使人容易抑郁。皮质醇是一种参与应激反应的主要激素,在抑郁症患者中已经被广泛研究,尽管压力和抑郁之间的关系已经变得很清楚,不仅仅是一对一的关系。抑郁症患者可能血浆皮质醇水平升高,脑脊液中促肾上腺皮质激素释放激素水平升高。此外,抑郁症患者可能有一个增大的肾上腺皮质和较小的海马体,导致BDNF减少,从而减少神经形成。
基因因素、环境因素可能导致MDD的发展。MDD也可能由以下因素触发:酒精或药物滥用;某些疾病,如癌症或甲状腺功能减退;特殊类型的药物,包括类固醇。
随着社会经济的不断发展,生活节奏的加快,社会竞争日益激烈,人们的心理压力逐渐增大,抑郁症发病率逐年上升,据世界卫生组织估计全世界抑郁症患病率约3%~5%,约 1~2亿人。根据Informa的数据,MDD的发病人数U.S.为22,960,245,Europe为18,056,903,Japan 6,890,973,合计4790万人。
治疗现状:
MDD通常通过药物和心理疗法来治疗。一些生活方式的调整也可以帮助缓解某些症状。患有严重MDD或有伤害自己想法的人在治疗期间可能需要住院。有些人可能还需要门诊治疗,直到症状好转。
抗抑郁药物包括:
选择性5-羟色胺再摄取抑制剂(SSRIs)。SSRIs包括一些知名药物,如氟西汀(百忧解)和西酞普兰(赛莱卡)。它们的副作用发生率相对较低,大多数人耐受良好。
其他药物。三环类抗抑郁药和被称为非典型抗抑郁药的药物可能在其他药物无效的情况下使用。它们会引起一些副作用,包括体重增加、性功能障碍和嗜睡等。
来自初级护理患者样本的纵向数据发现,大约45%的MDD患者在最初使用地西普拉明、氟西汀或咪普拉明治疗两年后获得缓解(HAM-D小于或等于7)(Simon, 2000)。同样比例的患者症状在两年内得到改善,因此他们不再被归类为MDD患者。
MDD治疗面临的主要问题是药物起效慢、响应率还有待提高、部分MDD非常难治。
第二部分 公司研究:Relmada Therapeutics, Inc. (RLMD)
MDD适应症药物为d-Methadone。
d-Methadone的活性成分为右旋美沙酮(右美沙酮)。美沙酮有左旋和右旋两种光学异构体,左旋美沙酮的镇痛作用为右旋体强8~50倍,右旋体没有呼吸抑制和成瘾性,临床镇痛常用其消旋体。
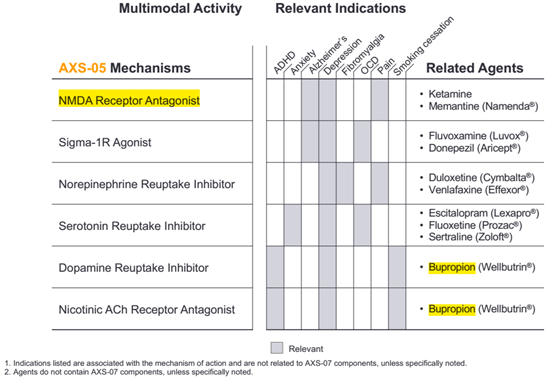
右美沙酮是外消旋美沙酮的d光学异构体,是n -甲基- d -天冬氨酸(NMDA)受体的拮抗剂。REL 1017(右美沙酮)是一种NMDA受体拮抗剂,作用靶点与开他敏相同,但似乎没有与开他敏治疗有关的拟精神病的副作用。
该药为粉末剂型,分散于Ocean Spray® Diet Cranberry Juice中,口服给药。
Phase IIa - TRD (Adjunctive),与stable background antidepressant therapy联用,患者对1-3种抗抑郁疗法无响应。
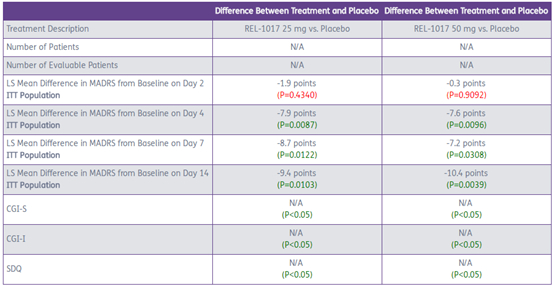
关键数据如下:
药物效果非常好,就MADRS减少的数值来看,比强生的NMDA受体拮抗剂Spravato似乎更强。目前还未发现明显副作用。
Spravato是开他敏的s对映体(作用靶点与REL 1017相同),于2019年3月上市,理论上来说也可以通过联用抗抑郁药物达到相同的治疗效果,但是因为为鼻喷剂,在剂型上存在劣势。
Phase IIa - TRD (Adjunctive)数据公布于2019年10月15日,RLMD公司股价大涨134%。RLMD公司计划推动REL1017进入临床III期试验,目前未有时间表。
从REL 1017的作用机制来看,作用靶标NMDA,与AXSM的AXS-05中的右美沙芬类似。REL 1017的成功或许提高了投资者对于AXS-05的成功预期,AXSM的股价在10月15日也大涨13.1%。
VTGN的AV-101也为作用于NMDA,当天股价上涨8.42%,后连续上涨几日,累计涨幅近25%。
第三部分 公司介绍:Axsome Therapeutics(AXSM)
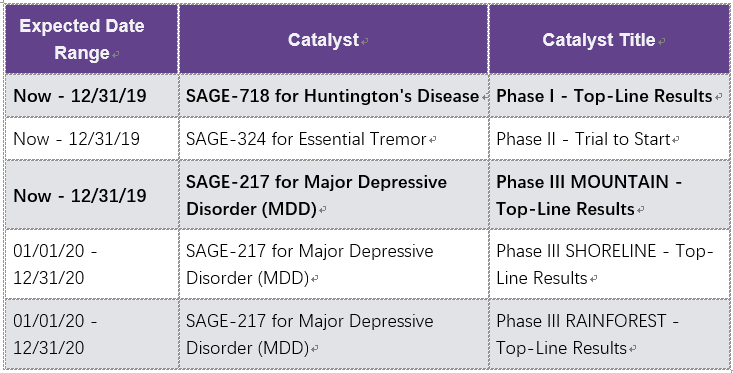
公司近期临床催化剂
1. GEMINI Phase 3 placebo-controlled trial of AXS-05 in MDD on track for readout of topline results in 4Q 2019
2. STRIDE-1 Phase 3 trial of AXS-05 in TRD on track for readout of topline results in 4Q 2019
3. MOMENTUM Phase 3 trial of AXS-07 in migraine on track for readout of topline results in 4Q 2019
4. CONCERT Phase 2 trial of AXS-12 in narcolepsy on track for readout of topline results in 4Q 2019
前两项有关MDD,后两项为其它适应症。
关键结论:
催化剂1,预计发布时间为12月,为积极结果的可能性较大。主要风险因素是患者严重程度为中重度MDD,无法确定II期患者严重程度。
催化剂2,预计发布时间可能也是12月。考虑到适应症为难治性的MDD,作用机制与RLMD存在一定相似性,较高概率出现积极结果。但认为若催化剂1积极,即便催化剂2不佳,股价仍能上涨。
催化剂3,发布时间无法缩窄。预计疗效积极的可能性较大,风险是有可能会有副作用,但不一定很大。
催化剂4,预计发布时间为12月。无法确认结果的±。但该适应症为孤儿适应症,可能对股价的负面影响较小。
2019-11-07 (美东)盘前发布《2019财年三季报》,根据公司的措辞,公司目前没有增发压力。
具体分析见下文
AXS-05用于MDD分析
组份:dextromethorphan(右美沙芬)+Bupropion(安非他酮)
给药方式:口服,BID
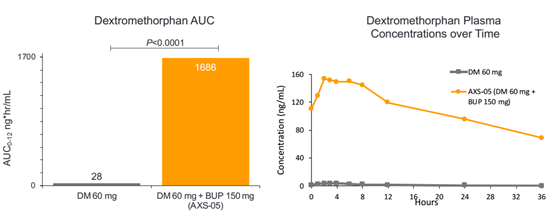
作用机制:安非他酮是一种常用的抑郁用药。NMDA受体拮抗剂已被用于包括抑郁在内的多种CNS疾病,右美沙芬为作用于NMDA受体拮抗剂,常用于镇咳,但右美沙芬与安非他酮联用后可显著提高右美沙芬的生物利用度。
现有临床试验结果:
Phase II – ASCEND
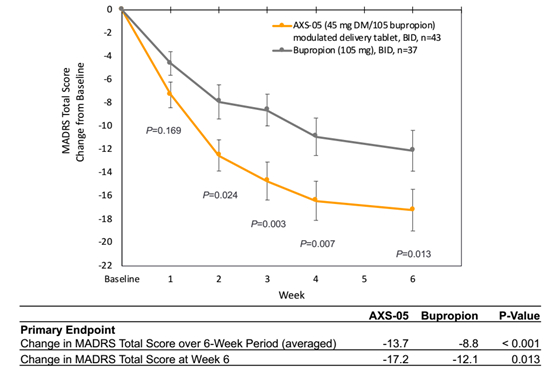
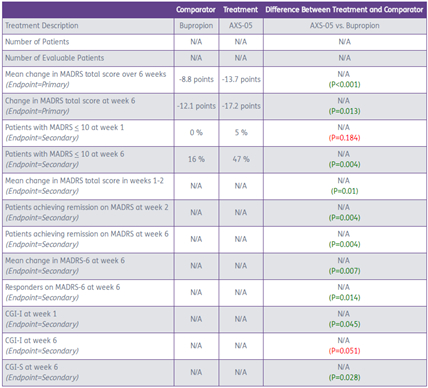
该试验为一项74人的II期试验,分为两个试验组,分别给药AXS-05和Bupropion。试验观察期为6周。
在MADRS评分中,Bupropion(安非他酮)通常与安慰剂产生3point的改善,安非他酮是抑郁症治疗中一个受认可的治疗分子,这使AXS-05的疗效令人印象深刻。既往数据还表明,经过AXS-05治疗后,第2周即达到了显著性差异,SOC一般需要6-8周才能起效。
AXS-05的副作用较少,不良反应发生率与Bupropion相当,试验组留存率更高。AXS-05未出现拟精神病症状、体重增加或性功能障碍,这些副作用是其它抑郁治疗药物(包括抗精神病药、SSRIs和SNRIs)多少会有的。
Informa公布的数据如下:
Phase II – ASCEND的Topline试验结果于2019年1月7日公布,ASXM股价当日大涨161.22%。5月28日小幅度更新ASCEND试验结果。股价高位维持。
催化剂分析:
1. GEMINI试验
试验设计与II期试验ASCEND基本相同。但ASCEND未注明MDD的严重程度,GEMINI患者为中重度的MDD。
10月16日,公司宣布试验患者招募完成并确认试验结果将于2019Q4发布,按照6周的试验设计,预计试验结果将在12月公布。
2. STRIDE-1试验
试验招募的患者为难治性的MDD(也称为TRD),这类患者曾接受过1-2种抗抑郁疗法(相当于二三线治疗),但响应不佳。试验亦设计为6周。
值得一提的是,该试验于2016年启动,但直到05/06/2019才宣布患者招募完成。AXSM在10月2日宣布了GEMINI的试验进度,同时宣布STRIDE-1的试验结果也会在2019Q4公布。
推测公司原本计划AXS-05应用在TRD,但患者招募进展缓慢。后ASCEND试验出乎意料地好,公司也顺便野心勃勃将适应症拓展到了MDD。根据既往的试验数据,多个时间点均显示了良好的疗效和较好的安全性,虽然GEMINI可能选择了更严重(无法确认)的患者,但推测III期试验GEMINI结果积极的可能性较高;STRIDE-1试验选择的患者较为严重,与RLMD的REL1017机制类似,出现积极结果的可能性较高,如果不出现积极结果,因为催化剂1的试验结果积极,股价仍能维持一定涨幅。
AXS-07 for Migraine
药物组份:meloxicam(美洛昔康)和rizatriptan(利扎曲坦)
作用机制:
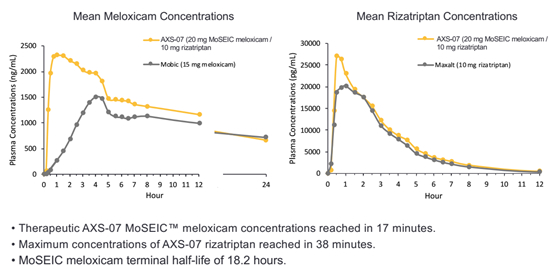
美洛昔康是一种新型的偏头痛药物分子。利扎曲坦是一种有效的5HT1B/D激动剂。二者联用后可改变两种药物的药代动力学性质,如下图所示,包括美洛昔康的快速吸收,血药浓度增加,半衰期更长;利扎曲坦的吸收也加快。因而有如下所示的效果。
催化剂分析:
AXS-07在完成I期PK试验后直接开始了III期临床试验。
此次要公布的MOMENTUM III期试验设计:用于既往效应不佳的偏头痛患者症状的快速缓解。
试验组分为AXS-07、美洛昔康、利扎曲坦、安慰剂四组。
主要试验终点为服药后2小时的止痛效果。次要终点为2-24小时疼痛的持续缓解。
AXS-07在未经过药效验证的条件下即开始III期试验,有点冒进。但是美洛昔康的快速吸收或可带来较好的短期疼痛缓解。半衰期延长对于疼痛的持续缓解应有较好作用。但是明显较高的峰值血药浓度有可能带来副作用。
美洛昔康的副作用包括胃肠道反应(常见消化不良、恶心、腹痛或腹泻;罕见溃疡、出血或穿孔);贫血、白细胞减少或血小板减少、瘙痒、皮疹;口炎;轻微头晕、头痛;水肿、血压升高等。常见肝酶升高(10%),偶见肾损害(0.4%)。停药后大多消失。
该试验的Topline试验结果原本预计2020Q1发布,但发生了提前,2019年10月2日AXSM公司确认2019年Q4将发布。
AXS-12 for Narcolepsy
Narcolepsy:使人衰弱的睡眠障碍,其特征是白天过度嗜睡和昏厥。
该症为Orphan Disease,该药已获得Orphan资格。
AXS-12为一种新型的化学分子实体,为去甲肾上腺素再摄取抑制剂。
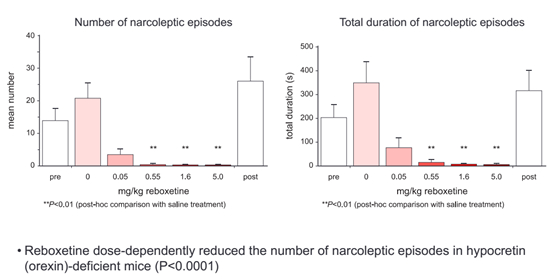
既往动物试验数据:
选择了食欲素缺乏的小鼠模型,有疗效。但是该动物模型与真实人类存在较大区别。
催化剂分析:
即将公布的是II期Topline(该试验未进行I期试验),选择的患者患有Cataplexy and Excessive Daytime Sleepiness in Narcolepsy。试验终点为第2和第5周时,cataplexy attacks数量较基数水平的变化。
该试验结果原计划2019年H1发布,发生延迟。
2019年10月21日,公司宣布患者招募完成并确认数据将于2019年Q4发布。根据试验设计,预计试验将在11月底完成,数据发布时间预计为12月。
JAZZ的Sunosi作用机制与AXS-12有类似之处,2019年3月获批用于Narcolepsy,但主要用于excessive daytime sleepiness associated with narcolepsy or obstructive sleep apnea (OSA)。
综上,该试验结果存在较大的不确定性。
财务状况
2019-11-07 (美东)盘前发布《2019财年三季报》。
截止Q2的财务状况如下:
第四部分 SAGE Therapeutics(SAGE)
短期主要催化剂
目前仅关注2019年的催化剂
关键总结:
SAGE-217用于MDD治疗的机制清晰,在PDD和MDD适应症上均在一定程度上被证明了有效性。
年内将发布SAGE-217用于MDD的名为MOUNTAIN的III期临床数据。试验方案选择了MDD患者(未注明严重程度),与既往的入组中重度MDD存在严重程度的区别,因此存在一定风险。
Zulresso在6月24日正式上市,Q3的销售表现将较大程度影响公司股价。Q3财报将在2019-11-12盘前发布。
SAGE-217 for Major Depressive Disorder (MDD)
作用机制:SAGE-217作为一种口服的GABA-A Receptor抑制剂。GABA是中枢神经系统中很重要的抑制性神经递质,它是一种天然存在的非蛋白组成氨基酸,具有极其重要且复杂的生理功能,包括镇静神经、抗焦虑。
在抑郁领域开发了两个适应症:PDD和中重度MDD。
SAGE-217 for PDD
PDD适应症药物是SAGE公司当前最值钱的产品,Phase IIIa - ROBIN (PPD-201)的Topline结果发布于01/07/19,股价当日上涨42.68%,当日收盘价至139.12,后股价一路上涨,最高至193.56。
公司另有一款注射给药的GABA-A Receptor抑制剂Zulresso,已于2019年3月获批,2019年7月上市销售。
SAGE-217 for MDD
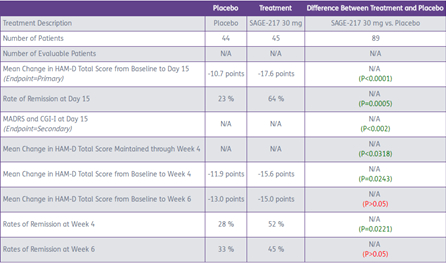
2017年12月7日,SAGE-217用于中重度MDD的II期数据发布,导致公司股价大涨70.04%。
关键试验数据如下
本次试验选择中重度的MDD患者。主要临床终点的观察期为14天。
Phase III - MOUNTAIN (MDD-301)试验的受试者对象为MDD患者,相当于扩大了人群范围。主要临床终点为15天HAM-D。
虽然GABA-A用于抗抑郁的效果在PPD上经过了验证,但一般用在中度或重度患者中可能更有效。因此MOUNTAIN试验结果存在一定的风险。
SAGE-718 for Huntington's Disease
SAGE-718是以氧甾醇为基础的NMDA受体正变构调制剂(PAM)。
本次要公布的I期临床设计为正常人体及亨廷顿氏舞蹈病早期症状的患者,人数仅为10人。试验主要考察安全性、耐受性和PK性质。预计对股价的影响不会很大。
财务状况
截止Q2末,公司共有各类现金资产合计12亿美元。公司在2019年2月进行了一次增发,增发价150美元/股。公司暂无增发风险。
Zulresso在6月24日正式上市,7月开始产生收入。Q3的财报将影响股价。
本文来自基岩研究院—博思二毛
免责声明
报告的全部内容只供做参考之用,并不构成投资建议,也并非作为买卖、认购股票或其它金融工具的保证。基岩研究院对这些信息的准确性和完整性不作任何保证,也不保证所包含的信息和建议不会发生任何变更。投资者依据本报告提供的信息进行证券投资所造成的一切后果自负。
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。