HZNP: 首个甲状腺眼病治疗药物研发商!
近日,FDA皮肤科与眼科专家委员会12名成员全票支持批准Horizon Therapeutics的IGF-1R抗体药物Teprotumumab,用于治疗甲状腺眼病(thyroid eye disease,TED), 如果获得批准,teprotumumab将是唯一一款治疗TED患者的获批疗法,将满足重大未竟医疗需求。公司股价近年来扶摇直上,究竟还有多大的上涨空间。。。
关键信息
1、HZNP有两个事业部,孤儿药和风湿病事业部与基础药品事业部。市场对孤儿药和风湿病事业部预期较高,不看好基础药品事业部发展前景。
2、孤儿药和风湿病事业部的核心已上市产品为Krystexxa,2018年净销售额为2.59亿美元,每年保持两位数增长,市场潜力超过7.5亿。另外HZNP还启动了Krystexxa的MIRROR研究(Krystexxa联合甲氨蝶呤降低免疫反应)和PROTECT研究(针对肾移植术后痛风失控患者)。预计在2020年初获得Krystexxa联合甲氨蝶呤在14例患者中的开放性研究的初步数据。
3、孤儿药和风湿病事业部的核心在研产品为Teprotumumab,用于治疗活动性甲状腺眼病(TED)。FDA授予了Teprotumumab突破性疗法、快速通道和孤儿药资格,HZNP已经向FDA提交BLA申请,PDUFA日期为2020年3月8日。
4、截至2019年9月30日,HZNP的现金和现金等价物为8.84亿美元。2019年Q3发布全年业绩指引:销售额在12.8-13.0亿美元,Krystexxa全年的净销售额增长将超过25%,全年调整后的EBITDA预计在4.65-4.75亿美元。
一、公司简介
Horizon Therapeutics(原名Horizon Pharma,HZNP)是一家处于商业开发阶段的生物制药公司,专注于开发和收购治疗罕见病和风湿性疾病的前沿治疗药物。公司目前有两个事业部:孤儿药和风湿病事业部与基础药品事业部。目前公司的核心产品都是通过收购获得。
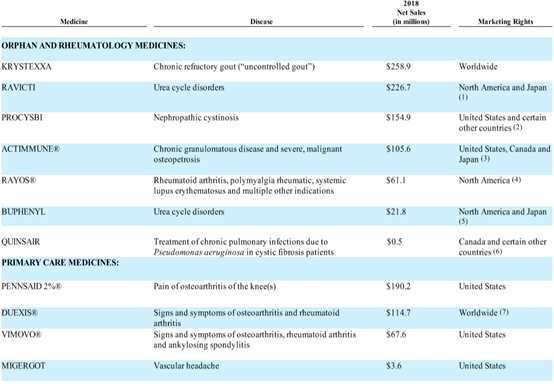
二、已上市产品情况
孤儿药和风湿病事业部
KRYSTEXXA是一种聚乙二醇尿酸特异性酶(尿酸酶),是美国FDA批准的第一个也是唯一一个治疗痛风失控的药物。痛风患者无法维持正常血清尿酸(sUA),传统疗法如黄嘌呤氧化酶抑制剂(XOIs)不能很好的控制其症状和体征。Krystexxa具有快速逆转疾病进展的独特作用机制。与传统的XOI疗法不同,Krystexxa能将尿酸转化为尿囊素,尿囊素是一种水溶性分子,人体可以通过尿液轻易地将其排出体外。尿囊素的肾排泄效率是尿酸排泄效率的10倍。Krystexxa的III期临床结果显示,在第3个月和第6个月采集的样本中80%患者的sUA维持在较低水平,其中42%的Krystexxa患者达到完全缓解,而安慰剂组为零;Krystexxa患者中45%的人在6个月的时间里完全解决了痛风石问题,而安慰剂组只有8%。此外,传统的XOI痛风疗法会给肾脏带来额外的负担,并且有剂量限制,但Krystexxa已被证明在慢性肾病(CKD)患者中的安全性和有效性,CKD痛风失控患者不需要调整剂量。
Krystexxa目前没有直接的竞争对手,Selecta的SEL 212(Pegadricase与免疫调节剂联合)已经完成了II期临床试验,并在2019年3月开始与Krystexxa为期6个月的头对头试验。SEL 212还需要进行III期的临床研究,上市时间还不确定。
在美国约有830万痛风患者,其中有超过10万的痛风失控患者。Krystexxa在2010年或美国FDA批准,2016年1月公司收购Crealta Holdings LLC时,Krystexxa的年销售额约为6000万美元,而且增长不大。2018年Krystexxa的年销售额为2.59亿美元,预计2019年约为3.1亿美元,保持两位数以上增长。Horizon预计Krystexxa的巅峰销售额超过7.5亿美元,如果扩展适应症获批,市场潜力会翻倍。
RAVICTI是一种氮结合剂,2018年12月FDA批准用于治疗年龄在2岁及以上的某些尿素循环障碍(UCDs)患者。该产品用于尿素循环障碍不能单纯通过蛋白质饮食控制或氨基酸补充方法进行控制的患者。Ravicti必须与蛋白质饮食控制一起使用,在一些病例中还需要膳食补充剂。UCDs是一种遗传性代谢性疾病,由构成尿素循环的一种酶或转运体缺乏引起,可以导致血液中氨含量过高的,进而引起不可逆转的脑损伤、昏迷或死亡。
美国大约有2,600名UCDs患者,其中确诊患者约有1,000名。2018年Ravicti的年销售额为2.27亿美元,其中北美和日本地区为2.23亿,北美和日本以外地区为410万,北美和日本以外地区的版权在2018年12月出售给了Immedica。因UCDs的市场空间较低,预计后续增长缓慢以个位数增长。
PROCYSBI是一种半胱胺重酒石酸氢盐的微球缓释胶囊剂,FDA在2013年批准其用于治疗儿童和成人肾病型胱胺酸症(NC)。Procysbi和传统药物相比,主要的区别是可以连续控制胱氨酸浓度超过12小时,患者只需每 12 小时服用一次。而 传统药物,例如Cystagon 需昼夜不停地每 6 小时服用一次。
胱氨酸病是一种罕见的遗传性疾病,在美国约有500人,全球约有3000人,NC占已知胱氨酸病病例的95%。2018年Procysbi的年销售额为1.55亿美元,市场策略是替换Cystagon 的市场,因NC的患者群体较小,存在竞争药物,预计后续增长缓慢以个位数增长。
ACTIMMUNE是一种被称为干扰素γ-1b的生物合成蛋白质,类似于人体自然产生的一种蛋白质。适应症是慢性肉芽肿病(CGD)和严重恶性骨坏死(SMO)。Actimmune是FDA批准的唯一一种用于治疗CGD相关的严重感染,并延缓SMO患者的疾病进展的药物。
CGD是一种免疫系统缺陷的遗传性疾病。在CGD患者中,一种叫做吞噬细胞的白细胞存在缺陷,导致吞噬细胞不能产生超氧化物,无法杀死细菌和真菌等有害微生物。削弱了免疫系统,CGD患者容易出现复发性严重的细菌和真菌感染以及慢性炎症等疾病。这些病人很容易发展成肉芽肿,反复发生,并造成各种各样的问题。美国大约有1600名CGD患者。
SMO是骨坏死的一种形式,有时被称为大理石骨病或恶性婴儿骨坏死,因为它发生在非常年幼的儿童中。虽然具体患者群体数量还不清楚,但据估计,每25万名儿童中就有一名患有SMO,2016年美国约有6091万儿童(0-14岁),患者群体在200-300人间。
2018年Actimmune的年销售额为1.06亿美元,因CGD和SMO的市场空间较低,预计后续增长缓慢以个位数增长。
其他品种:RAYOS适用于多种疾病的治疗,例如类风湿关节炎(RA)、强直性脊柱炎、风湿性多肌痛(PMR)、原发性系统性淀粉样变、哮喘、慢性阻塞性肺病、系统性红斑狼疮等,Rayos在市场上存在很多竞争药物。BUPHENYL适用于所有新生儿酶缺乏(出生后28天内表现为完全酶缺乏)和有高血氨性脑病家族史的迟发性酶缺乏(出生的第一个月后表现为部分酶缺乏)的患者。QUINSAIR是抗生素药物左氧氟沙星的一种剂型,通过喷雾器吸入,用于治疗成人囊性纤维化伴慢性铜绿假单胞菌感染,Quinsair存在很多竞品。2018年Rayos、Buphenyl、Quinsair的年销售额分别为6110、2180、50万美元,这几个药物潜力较小。
基础药品事业部
Horizon的基础药品事业部销售的药物有PENNSAID 2%(2%的双氯芬酸钠),DUEXIS(布洛芬/法莫替丁),VIMOVO(萘普生/埃索美拉唑)和MIGERGOT四个药物。2018年的净销售额分别为1.90亿美元、1.15亿美元、6760万美元和360万美元,合计3.76亿美元。
基础药品的业绩指引预测销售可能会出现缓慢下滑。2018年所有基础药品的处方量都有所下降。市场对基础药品事业部未来的发展存在不确定性。Horizon首席执行官Walbert在Q1财报电话会议上明确表示,运营基础药品事业部可以收集现金流,并将其用于孤儿药/风湿病药的并购。ONeil Trader认为,基础药品事业部目前没有买家,这一业务要么在未来几年被出售,要么慢慢消亡,销量会适度下降。这部分业务仍对该公司的估值构成负担,但不会影响其现金流,因为非常盈利。Horizon的股价不会高于同行,至少在该公司剥离基础药品事业部之前不会。
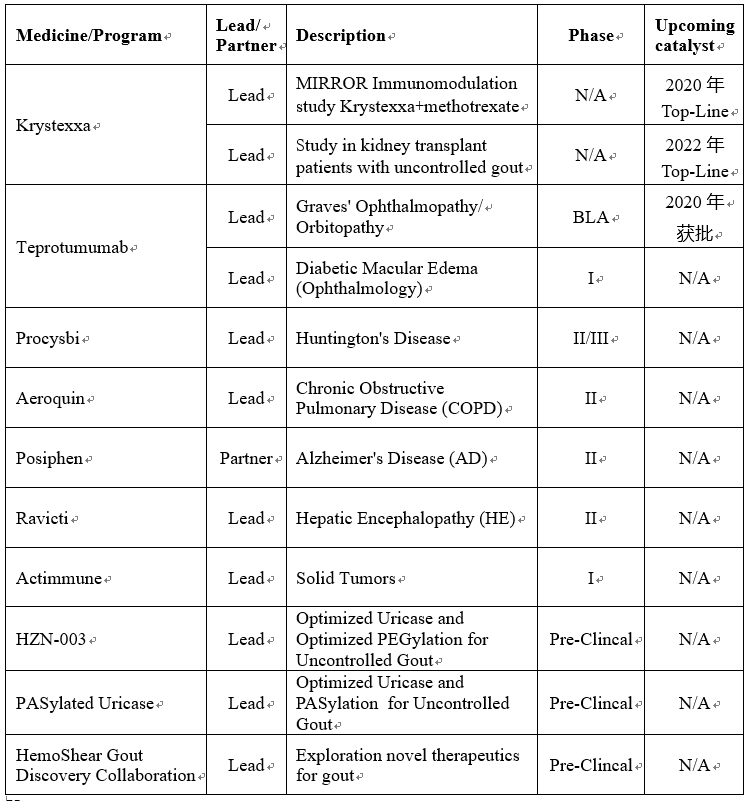
三、药物研发管线
Krystexxa
Krystexxa在2018年9月启动了MIRROR研究,旨在评估Krystexxa与甲氨蝶呤联合使用是否能提高Krystexxa的反应率,降低Krystexxa的免疫反应。Krystexxa是一种聚乙二醇化尿酸酶的重组蛋白,人体不能自然生成。所以一些接受Krystexxa治疗的人会产生药物免疫反应,从而失去对Krystexxa反应。这是限制Krystexxa使用量的关键原因,Horizon正在研究如何通过将Krystexxa与免疫调节剂药物配对,增加与Krystexxa完全反应的患者数量。甲氨蝶呤是风湿病学家最常用的免疫调节剂。11月11日,HZNP在ACR会议上展示了KRYSTEXXA联合甲氨蝶呤在10名成年痛风患者的研究结果(研究者发起),10例患者中有8例在24周的治疗中完全应答。两名患者停止了治疗,一名是由于失去反应和轻微的输液反应,另一名是由于甲氨蝶呤注射相关的问题。患者在治疗期间耐受性良好。预计在2020年初获得Krystexxa联合甲氨蝶呤在14例患者中的开放性研究的初步数据。如果MIRROR研究成功,Krystexxa的巅峰销售额将会显著提高。销售额的提高取决于反应率,如果反应率≥60%(概率较高)可以将销售潜力峰值提高70-100%,将增加Krystexxa的潜力市场为5.25-7.50亿美元。
HZNP在2019年10月启动PROTECT trial Krystexxa针对肾移植术后痛风失控患者的疗效的研究,结果预计在2022年公布。与普通人群相比,肾移植患者痛风的患病率增加了十倍以上,文献表明,高血清尿酸水平与器官排斥有关。管理失控痛风是最常见的和重要的未满足肾脏移植患者的需求之一。Horizon的首席执行官 Walbert预计肾移植术后痛风失控患者数量约有1万名,这将使Krystexxa的市场销量翻倍,每年将会增加额外的3亿美元的市场机会。
Teprotumumab
Horizon的另一个重要在研管线Teprotumumab,是一种全人源单克隆抗体(mAb),为胰岛素样生长因子1受体(IGF-1R)的靶向抑制剂。Horizon在2019年2月28日在美国临床内分泌学家协会(AACE)大会上公布了Teprotumumab III期(OPTIC研究)的阳性临床结果,该研究评估了Teprotumumab治疗活动性甲状腺眼病(TED)的有效性和安全性。
Teprotumumab的III期临床试验达到了主要终点,治疗组患者在第24周时眼球突出度减轻≥2mm(不恶化)的应答率为82.9%,安慰剂患者为9.5%(p˂0.001),该研究也达到了所有的次要研究终点。Teprotumumab的II期试验结果显示Teprotumumab组患者在第24周时眼球突出度减轻≥2mm(不恶化)的应答率为69%,安慰剂患者为20%(p˂0.001)。Teprotumumab的III期研究数据优于II期研究数据,很少在III期研究中看到药物报告有更好的结果,所以数据公布当日,HZNP的股价涨幅达到33%。
TED是一种罕见的眼病,目前FDA还没有批准治疗TED的疗法。Horizon已经向FDA提交了Teprotumumab的BLA申请,12月13日的ADCOM会议,咨询委员会全票认为Teprotumumab治疗的临床获益超过风险,鉴于Teprotumumab已获得了FDA授予的突破性治疗、快速通道资格和孤儿药称号,预计有望在2020年获批上市(PDUFA日期:3月8日)。在美国每年约有1.5万至2万名TED患者需要接受治疗,Horizon预测Teprotumumab的巅峰销售额超过7.5亿美元。
四、财务情况
截至2019年9月30日,HZNP的现金和现金等价物为8.84亿美元,净债务为5.34亿美元。公司7月份发行了6亿美元2027年到期的5.5%的新高级票据,用净收入和手头现金偿还了6.25亿美元的未偿债务,目前杠杆率为1.1倍,低于1年前的2.9倍。
2019年Q3发布全年业绩指引:销售额在12.8-13.0亿美元,Krystexxa全年的净销售额增长将超过25%,全年调整后的EBITDA预计在4.65-4.75亿美元。
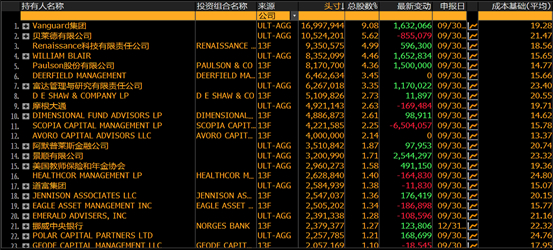
五、机构持仓情况
机构投资者持有大量股份,持股比例占90.65%,第一大股东为VANGUARD GROUP INC,持股比例为9.08%。
免责声明
报告的全部内容只供做参考之用,并不构成投资建议,也并非作为买卖、认购股票或其它金融工具的保证。基岩研究院对这些信息的准确性和完整性不作任何保证,也不保证所包含的信息和建议不会发生任何变更。投资者依据本报告提供的信息进行证券投资所造成的一切后果自负。
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。